
Multisystem Inflammatory Syndrome in Children – Initial Therapy and Outcomes.
Son et al.
N Engl J Med. 2021 Jul 1 ;385(1) :23-34 doi: 10.1056/NEJMoa2102605. Epub 2021 Jun 16. PMID : 34133855 ; PMCID : PMC8220972.
(ci-dessous : étude 1)

Treatment of Multisystem Inflammatory Syndrome in Children.
McArdle et al.
N Engl J Med. 2021 Jul 1 ;385(1) :11-22 doi: 10.1056/NEJMoa2102968. Epub 2021 Jun 16. PMID : 34133854 ; PMCID : PMC8220965.
(ci-dessous : étude 2)
Questions évaluées
- Quelle est la meilleure stratégie de prise en charge du MIS-C, en l’absence d’études prospectives randomisées contrôlées ?
- Quelle est la place des immunoglobulines (IVIG) et des corticoïdes ?
Type d’étude
Étude 1 :
- Rétrospective multicentrique (USA), registre de surveillance Covid-19.
Étude 2 :
- Étude observationnelle d’un registre de surveillance Covid-19 international.
Population étudiée
Étude 1 :
- 518 patients < 21 ans ayant reçu un traitement immunomodulateur dans 58 centres participants, entre le 15 mars 2020 et le 31 octobre 2020.
Étude 2 :
- 614 patients pédiatriques (tranche d’âge non précisée) introduits dans la base de données et ayant reçu ou non un traitement immunomodulateur dans 81 centres (34 pays) entre le 20 juin 2020 et le 24 février 2021.
Méthode
Étude 1 :
- Comparaison des patients ayant reçu IVIG seules versus IVIG + corticoïdes à J0 de traitement.
- Critères de jugement principal : score composite de dysfonction cardiovasculaire (dysfonction ventriculaire gauche et/ou besoin de vasopresseurs).
- Critères de jugement secondaires : dysfonction ventriculaire gauche à l’échocardiographie, besoin de vasopresseurs, persistance de la fièvre, nécessité de traitement immunomodulateur supplémentaire, durée de séjour en réanimation.
- Utilisation d’un score de propension basé sur la probabilité estimée de recevoir le traitement, avec deux approches successives (appariement puis confirmation des résultats par une méthode de pondération inverse sur la probabilité d’être traité).
Étude 2 :
- Comparaison de quatre groupes de traitement à l’admission : IVIG seules, IVIG + corticoïdes, corticoïdes seuls et pas de traitement immunomodulateur.
- Critères de jugement principaux : indice composite de support inotrope et/ou ventilation mécanique à J2 et réduction d’une échelle de sévérité (de 1 à 7, du moins sévère au plus sévère) de J0 à J2
- Critères de jugement secondaires : évolution des marqueurs biologiques d’inflammation, majoration du traitement immunomodulateur, temps nécessaire pour réduire d’un point l’échelle de sévérité, dysfonction ventriculaire gauche à l’échocardiographie, apparition d’anévrysmes coronaires, majoration du support ventilatoire et/ou hémodynamique après J0 et complications liées au traitement ou décès.
- Analyse de pondération de probabilité inverse entre les 3 groupes ayant reçu un traitement immunomodulateur. Comparaison des différents groupes avec le groupe IVIG seules.
Résultats essentiels
Étude 1 :
- Critère de jugement principal : Score composite de dysfonction CV plus bas dans le groupe IVIG + corticoïdes (risk ratio (RR) 0,56).
- Critères de jugement secondaires : moins de dysfonction VG (RR 0,46), moins de vasopresseurs (RR 0,54) dans le groupe IVIG + corticoïdes. Pas de différences significatives sur la persistance de la fièvre ou de durée de séjour en réanimation.
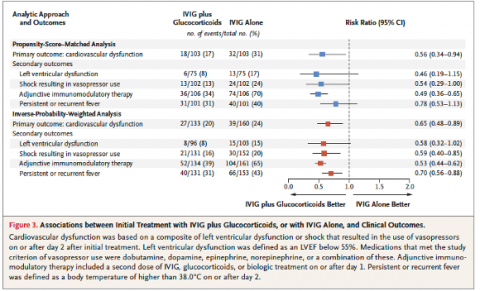
Étude 2 :
- Critères de jugement principaux : pas de différence significative de score composite ou d’échelle de sévérité entre les 3 groupes de traitement.
- Critères de jugement secondaires : moins de majoration de traitement immunomodulateur dans le groupe IVIG + corticoïdes en comparaison aux autres groupes (odds ratio : 0,18). Pas de différence de dysfonction VG. Pas de différence de décès ni de différence significative dans le temps d’amélioration. Trop peu d’anévrysmes coronaires dans les différents groupes pour effectuer l’analyse statistique. Marqueurs biologiques d’inflammation : défervescence plus rapide dans les groupes ayant reçu un traitement immunomodulateur en comparaison au groupe n’en ayant pas reçu mais pas de différences entre les groupes traités.
- NB : une analyse de sous-groupe de patients répondant aux critères de définition OMS de MIS-C semble montrer un léger avantage au groupe corticoïdes seuls comparé au groupe IVIG seules pour les deux critères de jugement principaux.
Points forts
Étude 1 :
- Grande hétérogénéité dans les groupes de départ. Tous patients confondus, les patients du groupe IVIG + corticoïdes étaient plus malades que les patients ayant reçu IVIG seules utilisation d’un score de propension apparié vu l’hétérogénéité des groupes 206 patients appariés (103 dans chaque groupe) sur les 518 ayant reçu un traitement immunomodulateur. Confirmation des résultats par une méthode de propension de probabilité inverse.
Étude 2 :
- Comparaison de 4 groupes de patients, y compris patients non traités.
- Tentative de résoudre les biais par une méthode de pondération de probabilité inverse.
- Évaluation des effets secondaires des traitements mais ce critère de jugement est à peine abordé dans la section résultats.
Points faibles
Étude 1 :
- Variabilité des définitions du MIS-C au cours du développement de la pandémie SARS-CoV-2 et inclusion de patients sans PCR ou sérologie au printemps 2020 vu la faible capacité de réalisation de tests durant cette période.
- Pas de définition des critères de traitement.
- Dans chaque groupe, un pourcentage important de patients (41% dans le groupe IVIG + corticoïdes et 63% dans le groupe IVIG seules) ont reçu un autre traitement immunomodulateur adjuvant (Antagoniste des récepteurs à l’IL-1, inhibiteurs du TNF, antagonistes des récepteurs à l’IL-6) dont le rôle n’a pas été évalué.
- Beaucoup de schémas de posologie différents pour les corticoïdes administrés.
- Perte de nombreux patients en raison de l’appariement sur score de pondération.
Étude 2 :
- Registre sur la base du volontariat de patients rencontrant les définitions de MIS-C mais aussi toute maladie inflammatoire suspectée post infection SARS-CoV-2 (définitions peu claires).
- Pas de contrôle sur l’exhaustivité du recensement dans le registre.
- Variabilité des définitions du MIS-C au cours du développement de la pandémie SARS-CoV-2.
- Utilisation fréquente d’autre traitements immunomodulateurs associés dont le rôle n’a pas été évalué.
Implications et conclusions
Depuis le début de la pandémie de SARS-CoV-2, les tableaux cliniques liés à la maladie se sont précisés. Dans la population pédiatrique, le MIS-C est maintenant reconnu comme une entité liée à ce virus. Néanmoins, les définitions et le recensement ont évolué dans le temps, et différents traitements immunomodulateurs ont été tentés et proposés. Il semble relativement bien établi que l’administration d’immunoglobulines et/ou de corticoïdes semble améliorer le devenir des patients souffrant d’un MIS-C modéré à sévère mais la place de ces traitements et le bénéfice d’une association reste à préciser. Dans ces deux études les caractéristiques de base des patients ayant reçu l’association IVIG + corticoïdes laissent penser que ce sont les patients les plus malades qui reçoivent la combinaison. Les deux études essaient de minimiser ce biais par leurs méthodes statistiques. Les résultats obtenus sont en concordance avec l’étude multicentrique française parue en février 20211. Vu l’innocuité relative de l’association IVIG + corticoïdes, les recommandations actuelles valident cette combinaison dans la prise en charge des MIS-C modérés à sévères2.
CONFLIT D'INTÉRÊTS
Article commenté par le Dr Laurent Houtekie, Service des soins intensifs pédiatriques, Cliniques universitaires Saint-Luc, Bruxelles, Belgique.
L'auteur déclare n'avoir aucun lien d'intérêt.
Le contenu des fiches REACTU traduit la position de leurs auteurs, mais n’engage ni la CERC ni la SRLF.
Envoyez vos commentaires/réactions à l'auteur (laurent.houtekie@saintluc.uclouvain.be) et/ou à la CERC.
Références
- Association of Intravenous Immunoglobulins Plus Methylprednisolone vs Immunoglobulins Alone With Course of Fever in Multisystem Inflammatory Syndrome in Children.
Ouldali N, Toubiana J, Antona D, Javouhey E, Madhi F, Lorrot M, Léger PL, Galeotti C, Claude C, Wiedemann A, Lachaume N, Ovaert C, Dumortier M, Kahn JE, Mandelcwajg A, Percheron L, Biot B, Bordet J, Girardin ML, Yang DD, Grimaud M, Oualha M, Allali S, Bajolle F, Beyler C, Meinzer U, Levy M, Paulet AM, Levy C, Cohen R, Belot A, Angoulvant F; French Covid-19 Paediatric Inflammation Consortium.
JAMA. 2021 Mar 2;325(9):855-864. doi: 10.1001/jama.2021.0694. Erratum in: JAMA. 2021 Jul 6;326(1):90. PMID: 33523115; PMCID: PMC7851757. - Severe COVID-19, multisystem inflammatory syndrome in children, and Kawasaki disease: immunological mechanisms, clinical manifestations and management.
Kabeerdoss J, Pilania RK, Karkhele R, Kumar TS, Danda D, Singh S.
Rheumatol Int. 2021 Jan;41(1):19-32. doi: 10.1007/s00296-020-04749-4. Epub 2020 Nov 21. PMID: 33219837; PMCID: PMC7680080.
CERC
B. HERMANN (Secrétaire)
A. BRUYNEEL
G. DECORMEILLE
S. GOURSAUD
N. HEMING
G. JACQ
T. KAMEL
G. LABRO
JF. LLITJOS
L. OUANES-BESBES
L. POIROUX
A. ROUZÉ