
Targeted Temperature Management for 48 vs 24 Hours and Neurologic Outcome After Out-of-Hospital Cardiac Arrest: A Randomized Clinical Trial
Hans Kirkegaard, Eldar Søreide, Inge de Haas et al.
JAMA. 2017;318(4):341-350
Question évaluée
Un contrôle ciblé de la température (CCT) entre 32°C et 36°C en post-arrêt cardiaque (AC) est recommandé au niveau national et international (1,2). Bien qu’actuellement recommandé pour une durée d’au moins 24h, sa durée optimale n’a cependant jamais été étudiée de manière randomisée. Cette étude se propose de comparer 2 durées de CCT : 24h versus 48h, en évaluant le pronostic neurologique 6 mois après un contrôle thermique à 33°C (hypothermie thérapeutique).
Type d’étude
Essai multicentrique international, randomisé, pragmatique, effectué dans 10 réanimations de centres hospitaliers universitaires de 6 pays d’Europe, entre février 2013 et juin 2016.
Population étudiée
Inclusion des patients ayant un score de Glasgow < 8 au décours d’un AC extra-hospitalier, présumé d’origine cardiaque, sur rythme choquable ou non choquable, et ayant une reprise d’activité circulatoire spontanée (RACS) stable d’au moins 20 minutes.
Exclusion des patients avec :
- Délai AC – RACS > 60 minutes
- AC présumé non cardiaque
- AC intra-hospitalier
- AC extra-hospitalier sans témoin avec un 1er rythme retrouvant une asystolie
- Délai entre l’AC et le refroidissement > 4h
- Défaillance neurologique pré-existante avec un CPC ≥ 3
- Choc cardiogénique réfractaire
- Pontage coronaire en urgence
- Hémorragie cérébrale ou AVC en phase aiguë
- Femme enceinte
- Maladie terminale
- Absence de consentement de la famille ou du médecin traitant.
Méthodes
Randomisation de 355 patients, stratifiée sur l’âge, le centre et le rythme cardiaque initial, entre contrôle thermique de 24h (n = 179) ou de 48h (n = 176). L’analyse pour le critère principal est faite en intention de traiter modifiée (2 retraits de consentement et un perdu de vue) : 24h (n=176) vs 48h (n=175) et en per-protocole (172 vs 164 patients respectivement).
Le critère de jugement principal est l’état neurologique à 6 mois, évalué en aveugle par un comité extérieur aux services de réanimation, à l’aide du score CPC (Cerebral Performance Categories). Les CPC 1 (alerte, capable de travailler et menant une vie normale) et 2 (invalidité modérée et suffisante pour mener une activité professionnelle partielle) sont jugées comme une évolution neurologique favorable. L’objectif est de montrer une différence de 15% sur le critère de jugement principal (65% vs 50% dans les bras 48 et 24h respectivement, chiffre estimé à partir des études antérieures).
Les critères de jugement secondaires sont :
- La mortalité en réanimation, à l’hôpital et à 6 mois
- Le délai de survie du patient (« time to death »)
- La survenue d’effets secondaires
- La durée d’hospitalisation en réanimation et à l’hôpital
- La durée de ventilation mécanique.
Réalisation de l’hypothermie par des méthodes invasives (cathéter intra-vasculaire) dans la majorité des cas (62%) mais aussi par des méthodes externes. La « durée du CCT » (24 ou 48h) commence dès que le patient atteint une température <34°C. Le réchauffement à la fin de chaque période de CCT jusqu’à 37°C est réalisé à une vitesse maximale de 0.5°C/h.
Résultats essentiels
Sur les 351 patients analysés (groupes 48h vs 24h respectivement), les caractéristiques des 2 populations à l’inclusion sont similaires dans les 2 groupes : âge (61 vs 60 ans), sexe masculin (82 vs 84%), coronaropathie préalable (16 vs 15%), AC à domicile (51 vs 58%), AC devant témoin (87% vs 84%), AC sur rythme initial choquable (91% vs 86%), délai AC – 1er massage cardiaque (1 vs 1 min), délai 1er massage – RASC (8 vs 8 min), coronarographie (83 vs 82%), angioplastie coronaire (43 vs 39%), lactate à l’admission (2,6 vs 2,6 mmol/L).
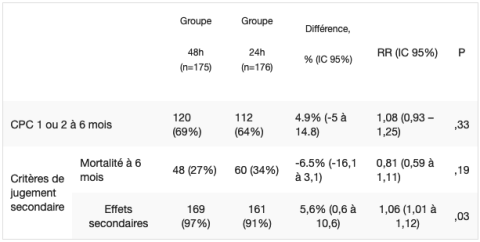
IC : intervalle de confiance ; RR : risque relatif.
Pour les événements secondaires quand ils sont évalués séparément, on note :
- Plus d’hypotension dans le bras 48h (62% vs 49%, p = 0,01)
- Plus d’infections dans le bras 48h : 42% vs 32%, p = 0,04 (en excluant les pneumopathies qui ne sont pas significativement différentes : 49% vs 43%, p = 0.24)
- Plus de saignements sévères, nécessitant plus de 2 CG/j dans le bras 24h (1% vs 4%, p = 0,03)
En considérant le critère « au moins un évènement indésirable », on retrouve plus de complications dans le bras 48h. De plus, les durées d’intubation et d’hospitalisation en réanimation sont significativement plus importantes (p<0 ;001) dans le bras 48h : 120h vs 87h et 6,3 vs 4,9 jours respectivement. A l’inverse, la durée d’hospitalisation totale n’est pas différente (11 vs 12 j).
Aucune différence n’a pu être retrouvée dans l’ensemble des sous-groupes prédéfinis. Enfin, les analyses per-protocole retrouvent les mêmes résultats.
Commentaires
Le schéma optimal du CCT n’est pas encore précisément déterminé pour plusieurs paramètres [1] : sélection des patients pouvant en bénéficier, niveau de température (actuellement recommandé entre 32 et 36°C), délai optimal pour le débuter (induction la plus rapide possible, en pré- ou en intra-hospitalier ?), méthode préférentielle (externe vs. interne), durée du réchauffement (actuellement suggérée comme étant ≤0.5°C/h) et enfin durée optimale de CCT, objet de cette étude.
Expérimentalement, la plupart des études ont montré un intérêt potentiel en faveur d’un CCT plus prolongé [3]. Plusieurs études chez le patient en post-AC ont retrouvé des résultats discordants concernant le possible intérêt d’un CCT prolongé [4,5].
La durée actuellement suggérée dans les recommandations internationales pour le CCT après AC est d’au moins 24h [1]. Cette recommandation de grade « faible » est basée sur un très faible niveau de preuve : résultant essentiellement des 2 études randomisées les plus importantes sur le sujet où la durée de CCT était de 24h [6,7]. Il est à noter que les recommandations de 2010 basée sur les études randomisées des « années 2002 » préconisaient une durée de 12 à 24h. On a donc assisté quelque peu au fil des années à une augmentation modérée de la durée de CCT en fonction des essais disponibles. Cette étude permet donc de penser que le délai optimal de CCT pour la population testée est bien de 24h. Il est possible, au vu de la tendance statistique retrouvée, que certains sous-groupes de patients restant à déterminer pourrait bénéficier de durée plus ou moins variables de CCT (durée prolongée si lésions neurologiques importantes vs. durée plus courte si effets secondaires ou pas de lésions à traiter par CCT). Enfin, les recommandations actuelles préconisent également qu’après le réchauffement progressif jusqu’à 37°C, une normothermie devrait être maintenue pendant 72h après l’AC, comme réalisé dans l’étude TTM dont l’effectif est le plus important [7].
Enfin, l’encéphalopathie post-anoxique néonatale est l’autre pathologie où le CCT est validé, avec une recommandation forte en faveur d’une température maintenue à 33-33,5 °C, réalisée dès que possible et ce pendant une durée de 72h. Un essai randomisé dans cette population avait évalué l’intérêt d’une hypothermie plus profonde : 32 vs 33.5°C ou plus prolongée : 72 vs 120h [8]. De manière similaire, l’étude s’était avérée négative sur le plan pronostique et avait même retrouvé plus de saignements majeurs dans le groupe 120h.
Points forts
- 1ère étude d’excellente qualité méthodologique sur ce sujet (un seul perdu de vue notamment) ;
- Donne une piste solide sur la durée optimale du CCT (et donc de la « dose de contrôle thermique » à réaliser) pour permettre l’amélioration du pronostic neurologique ;
- Objectif principal (évolution favorable) colligé en aveugle par des médecins indépendants même si le traitement 24 vs 48h n’était pas possible à réaliser en aveugle ;
- Contrôle thermique et traitements associés (sédation, ventilation assistée, ACSOS) bien spécifiés (dans le supplément) avec méthodes de refroidissement optimisées, à l’image de l’étude TTM (7) ;
- Protocole standardisé d’évaluation neurologique post-AC (« neuro-pronostication ») et de limitation thérapeutique réalisés par du personnel médical indépendant de l’équipe de recherche.
Points faibles
- Population sélectionnée : d’après les caractéristiques des patients inclus (No Flow 1 minute, lactate sub-normal à l’admission, 88% de rythme choquable, témoignant d’une population à plus faible risque d’anoxie cérébrale), ceci posant la question de la validité extrinsèque (biais de sélection et application à une population « standard ») ;
- Nombre d’AC à domicile dans le bras 24h semblant plus important (102 vs 89 patients) constituant un possible biais de sélection malgré la randomisation ;
- Onze patients (6,3%) dans le bras 48h ont été réchauffés avant terme vs 3 patients (1,7%) dans le groupe 24h, ceci pouvant introduire un biais statistique ;
- Neuropronostication: malgré le protocole standardisé, seuls 45% des patients ont bénéficié d’un EEG vs 23% de potentiels évoqués somesthésiques ;
- Objectif visé difficilement réalisable voire impossible (15% de différence entre les 2 bras) avec, de plus, un bras contrôle présentant au final une survie sans séquelle neurologique majeure plus élevée que celle attendue (64% vs 50%) ;
- Nombre inclus de malades limité, ne permettant pas de mettre en évidence une différence significative, donc un manque de puissance probable ;
- Nombre limité d’inclus ne permettant pas non plus de donner des pistes sur les éventuels sous-groupes à considérer : intérêt d’une durée plus prolongée en cas de lésions neurologiques accessibles (patients les plus sévères neurologiquement) en l’absence d’effets secondaires décelables ?
Conclusions
Cette étude permet d’avancer sur la durée du CCT en post-AC : elle conclue que, pour la population considérée, prolonger la durée de 24h supplémentaire n’apporte pas le bénéfice escompté, à savoir une amélioration de 15% de l’évolution favorable. On note juste une tendance en faveur de 48h de CCT contre-balancée par une augmentation significative des effets secondaires avec cette durée.
Conflit d'intérêts
Article commenté par Antoine TROGER et Nicolas DEYE.
N. DEYE déclare avoir bénéficié de prises en charge de frais de congrès par les sociétés BARD et ZOLL.
A. TROGER ne déclare aucun conflit d’intérêt.
Le contenu des fiches REACTU traduit la position de leurs auteurs, mais n’engage ni la CERC ni la SRLF.
Envoyez vos commentaires/réactions à l’un des auteurs (nicolas.deye@aphp.fr) ou à la CERC.
Liens utiles
- Temperature Management After Cardiac Arrest: An Advisory Statement by the Advanced Life Support Task Force of the International Liaison Committee on Resuscitation and the American Heart Association Emergency Cardiovascular Care Committee and the Council on Cardiopulmonary, Critical Care, Perioperative and Resuscitation. Donnino MW, Andersen LW, Berg KM, Reynolds JC, Nolan JP, Morley PT, Lang E, Cocchi MN, Xanthos T, Callaway CW, Soar J; ILCOR ALS Task Force. Resuscitation. 2016;98:97-104.
- Targeted temperature management in the ICU: guidelines from a French expert panel. Cariou A, Payen JF, Asehnoune K, Audibert G, Botte A, Brissaud O, Debaty G, Deltour S, Deye N, Engrand N, Francony G, Legriel S, Levy B, Meyer P, Orban JC, Renolleau S, Vigue B, De Saint Blanquat L, Mathien C, Velly L ; SRLF – SFAR In conjunction with the ANARLF, the GFRUP, the SFMU, and the SFNV. Ann Intensive Care. 2017 Dec;7(1):70.
- Prolonged therapeutic hypothermia is more effective in attenuating brain apoptosis in a swine cardiac arrest model. Suh GJ, KwonWY, Kim KS, et al. Crit Care Med. 2014;42(2):e132-e142.
- Do lower target temperatures or prolonged cooling provide improved outcomes for comatose survivors of cardiac arrest treated with hypothermia? Kagawa E, Dote K, Kato M, et al. J Am Heart Assoc. 2015;4(9):e002123.
- Seventy-two hours of mild hypothermia after cardiac arrest is associated with a lowered inflammatory response during rewarming in a prospective observational study. Bisschops LL, van der Hoeven JG, Mollnes TE, Hoedemaekers CW. Crit Care. 2014;18(5):546.
- Hypothermia After Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 2002;346(8):549-556.
- Targeted temperature management at 33°C vs 36°C after cardiac arrest.Nielsen N,Wetterslev J, Cronberg T, et al.
N Engl J Med. 2013;369:2197-2206. - Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy: a randomized clinical trial.Shankaran S, Laptook AR, Pappas A, et al; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. JAMA. 2014;312(24):2629-2639.
CERC
G. MULLER (Secrétaire)
N. AISSAOUI
SD. BARBAR
F. BOISSIER
G. DECORMEILLE
D. GRIMALDI
S. HRAIECH
G. JACQ
JB. LASCARROU
P. MICHEL
G. PITON
A. YOUSSOUFA