
Adjunctive dexamethasone treatment in adults with Listeria monocytogenes meningitis: a prospective nationwide cohort study.
Brouwer MC and Van de Beek D. eClinicalMedicine 2023 :58 :101922 PMID 37007737
Question évaluée
Quel est l’impact pronostique de l’administration de dexaméthasone chez les patients ayant une méningite bactérienne communautaire documentée à Listeria monocytogenes ?
Type d’étude
Analyse rétrospective de données recueillies de 2006 à 2022 dans une cohorte néerlandaise colligeant les données de patients ayant une méningite bactérienne communautaire.
Population étudiée
Patients âgés de plus de 16 ans ayant une méningite bactérienne documentée à Listeria monocytogenes (culture du LCR positive à Listeria monocytogenes ou hémoculture positive à Listeria monocytogenes avec anomalies du LCR compatibles avec une méningite bactérienne). Les patients ayant une méningite nosocomiale, une méningite consécutive à un neuro-traumatisme ou à une neurochirurgie ainsi que ceux porteurs d’un dispositif neurochirurgical étaient exclus.
Méthode
Utilisation de la base de données d’un laboratoire néerlandais de référence pour la méningite bactérienne (réceptionne les échantillons de LCR et de sang d’environ 85% de tous les patients ayant une méningite bactérienne aux Pays-Bas, soit 17 millions d’habitants).
Comparaison du pronostic neurologique des patients ayant reçu une corticothérapie selon un protocole bien conduit (4 injections quotidiennes de 10 mg de dexaméthasone avec une première dose administrée avec la première injection d’antibiotique ou dans les 4h suivant la première dose, pendant 4 jours) à celui de ceux non traités par dexaméthasone ou traités avec un autre schéma d’administration (autre dose, première dose administrée 4h ou plus après la première dose d’antibiotique, durée inférieure à 4 jours à l’exclusion des patients décédés au cours des 4 premiers jours).
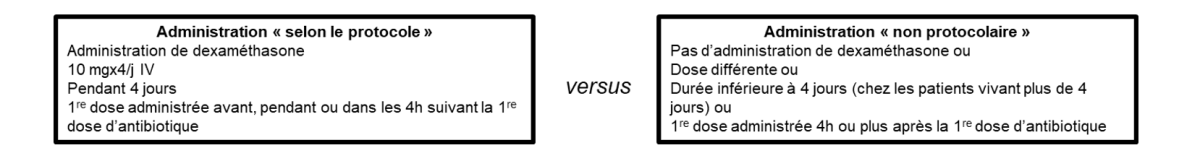
Le pronostic était évalué à la sortie de l’hôpital par le Glasgow Outcome Scale (GOS) allant de 1 (décès) à 5 (récupération satisfaisante), avec un pronostic défini comme « favorable » en cas de GOS égal à 5 et « défavorable » en cas de GOS allant de 1 à 4.
Résultats essentiels
Parmi les 2664 épisodes de méningite bactérienne communautaire, 162 (6%) patients avaient une méningite documentée à Listeria monocytogenes.
La dexaméthasone était administrée selon le protocole chez 52% des patients (n=83/161). Les autres ne recevaient pas de dexaméthasone (n=57/161, 35%) ou en recevaient selon un schéma non protocolaire (interruption au cours des 4 premiers jours après identification de Listeria monocytogenes n=10/161, 6% ; administration d’une dose différente ou plus de 4h après la première dose d’antibiotique n=11/161, 7%). Il n’y avait pas de différence clinique significative entre les patients ayant reçu la dexaméthasone selon le protocole et les autres. Une antibiothérapie empirique couvrant Listeria monocytogenes était administrée chez 80% des patients. Il y avait significativement plus de patients recevant une antibiothérapie empirique couvrant Listeria monocytogenes chez les patients recevant de la dexaméthasone selon le protocole que chez les autres patients (88% versus 68%, p=0,002).
Le taux d’évolution défavorable (GOS compris entre 1 et 4) à la sortie de l’hôpital était de :
- 72% chez les patients n’ayant pas reçu de dexaméthasone
- 60% chez les patients ayant reçu de la dexaméthasone moins de 4 jours (interruption après identification de Listeria monocytogenes)
- 55% chez les patients ayant reçu de la dexaméthasone avec une dose, une durée ou un délai d’administration par rapport à la première dose d’antibiotique différents de ceux du protocole
- 46% chez les patients ayant reçu de la dexaméthasone selon le protocole
Après ajustement sur l’âge, le score de Glasgow à l’admission, l’adéquation de l’antibiothérapie empirique initiale, un traitement par dexaméthasone selon le protocole était indépendamment associé à une réduction du risque d’évolution défavorable à la sortie de l’hôpital avec un odds ratio ajusté à 0,40 (IC95% 0,19-0,81 ; p=0,017), ainsi qu’à une réduction du risque de mortalité intra-hospitalière avec un odds ratio ajusté égal à 0,40 (IC95% 0,19-0,84, p=0,016).
Commentaires :
Cette étude observationnelle [1] a été menée par Diederik van de Beek, auteur néerlandais de l’essai randomisé contrôlé contre placébo publié en 2002 dans le New England Journal of Medicine démontrant l’efficacité de la dexaméthasone sur le pronostic neurologique et la mortalité des patients adultes ayant une méningite bactérienne communautaire tout germes confondus [2], efficacité d’autant plus marquée que la méningite était documentée à Streptococcus pneumoniae.
En 2017, l’étude observationnelle française MONALISA [3] mettait en évidence une association délétère entre l’administration de dexaméthasone et la mortalité chez les patients ayant une neurolistériose : la mortalité à 3 mois était de 48% chez les 32 patients traités par dexaméthasone contre 27% chez les 216 patients ne recevant pas de dexaméthasone (p=0,037). L’analyse multivariée montrait que l’administration de dexaméthasone était indépendamment associée à un surrisque de mortalité à 3 mois avec un odds ratio ajusté de 4,58 (1,50-13,9 ; p=0,008). Depuis la publication de cette étude, et malgré son caractère observationnel, le faible nombre de patients traités par dexaméthasone (n=32) et l’absence de précision concernant le délai d’introduction de la dexaméthasone par rapport à l’antibiothérapie (devait être administrée dans les premières 24h de la prise en charge), la Société Française de Pathologie Infectieuse recommande de ne pas poursuivre la dexaméthasone chez les patients ayant une listériose neuroméningée (recommandations de 2018) [4].
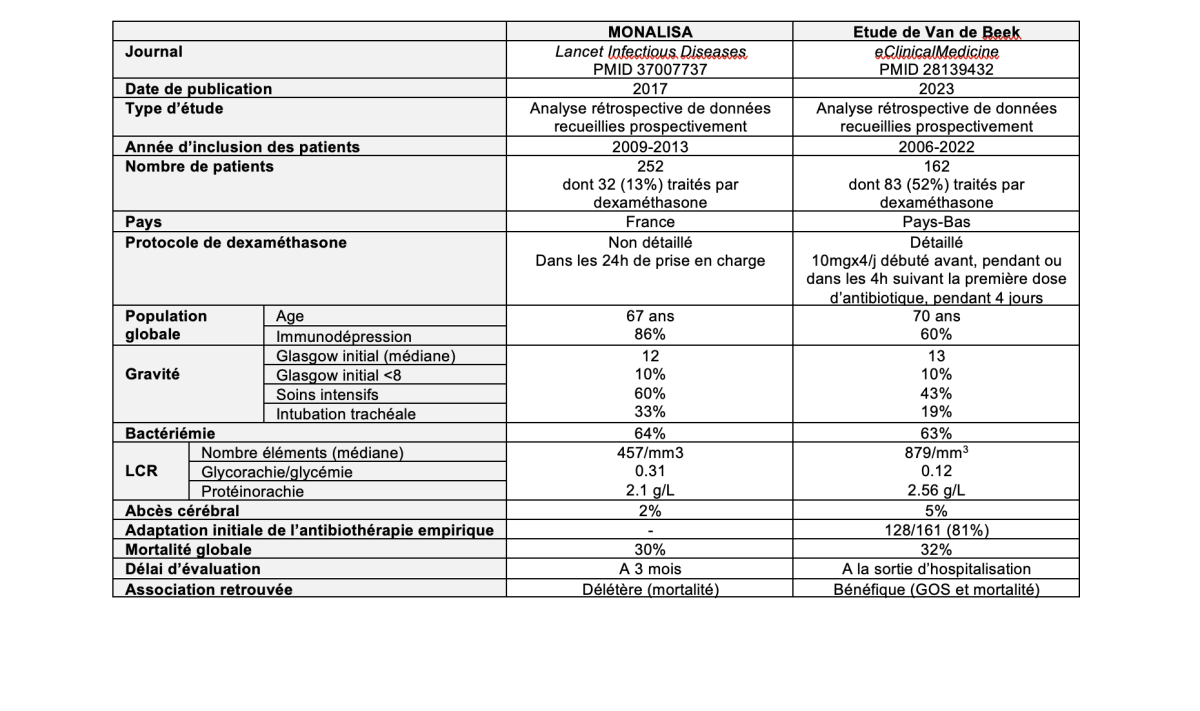
Un comparatif entre l’étude MONOLISA [3] et la présente étude [1] est disponible dans le tableau 1.
Comment expliquer que deux études de méthodologie similaire aboutissent à deux résultats totalement opposés (effet délétère de la dexaméthasone dans MONOLISA, effet bénéfique dans l’étude de Van de Beek) ? Voici quelques pistes de réflexion :
- Délai d’administration de la dexaméthasone par rapport à la première dose d’antibiotique. L’étude actuelle s’est intéressée exclusivement aux patients ayant reçu la dexaméthasone dans les délais préconisés par les recommandations de l’ESCMID de 2016 [5], c’est à dire avant, pendant ou dans les 4h suivant l’administration de la première dose d’antibiotique. A l’inverse, dans l’étude MONALISA, le délai d’introduction de la dexaméthasone n’était pas précisé, les patients catégorisés dans le groupe dexaméthasone devant la recevoir dans les 24 premières heures de la prise en charge. Or, il a été montré que la dexaméthasone est d’autant plus efficace lorsqu’elle est administrée avant ou pendant [2, 6] la première dose d’antibiotique afin d’éviter l’inflammation neuroméningée induite par la lyse bactérienne. Toutefois, la durée maximale à ne pas dépasser entre la première dose d’antibiotique et l’administration de dexaméthasone n’est pas connue. En cas d’impossibilité d’administration précoce (avant ou pendant la première dose d’antibiotiques), les recommandations européennes [5] autorisent une administration de dexaméthasone dans les 4h suivant la première dose d’antibiotique, alors que les recommandations françaises [4] et britanniques [7] autorisent un délai de 12h (avis d’experts). On ne peut éliminer une administration tardive (>12h après la première dose d’antibiotique) de dexaméthasone dans l’étude MONALISA.
- Nombre de patients, sévérité initiale et biais de sélection des patients. Dans l’étude MONOLISA, seulement 32 patients (13% des patients ayant une neurolistériose) étaient traités par dexaméthasone (contre 83 dans la présente étude). De plus, une proportion plus importante de patients étaient admis en soins intensifs et nécessitaient une ventilation invasive dans MONOLISA (Tableau). Il est possible que, dans l’étude MONOLISA, seuls les patients les plus graves aient été traités par dexaméthasone, tardivement, en sauvetage même si le score de Glasgow à l’admission ne différait pas entre les patients traités ou non par dexaméthasone.
- Délai d’évaluation du pronostic neurologique. Le pronostic n’est pas évalué au même moment de l’évolution de la maladie : mortalité à 3 mois pour l’étude MONALISA versus Glasgow Outcome Scale à la sortie de l’hôpital dans l’étude de Van de Beek. La durée d’hospitalisation n’est malheureusement pas rapportée dans la présente étude (par comparaison, les patients de la cohorte MONALISA étaient hospitalisés en médiane 23 jours). Il semble cependant peu probable que les patients de la présente étude traités par dexaméthasone se soient dégradés entre la sortie d’hospitalisation et le troisième mois, même si 60% des patients de la cohorte étaient immunodéprimés.
- Adéquation de l’antibiothérapie initiale. Dans l’étude de Van de Beek, l’inadéquation de l’antibiothérapie empirique (en pratique, l’absence de prescription empirique d’amoxicilline) était significativement plus fréquente chez les patients recevant un mauvais schéma de dexaméthasone, ce qui pourrait expliquer le moins bon pronostic neurologique des patients recevant un mauvais schéma de dexaméthasone. Cependant, l’inadéquation de l’antibiothérapie initiale n’était pas significativement associée à la mortalité ou à un pronostic neurologique défavorable à la sortie d’hospitalisation en analyse multivariée. Aussi, une analyse multivariée de sensibilité réalisée après exclusion des patients n’ayant pas reçu une antibiothérapie initiale adaptée montrait la persistance d’un bénéfice significatif de la prescription de dexaméthasone selon le protocole sur le pronostic neurologique.
Points forts :
- Question clinique pertinente et pragmatique
- Remise en question des résultats d’une étude antérieure ayant modifié les pratiques malgré un faible niveau de preuve
- Nombre élevé de patients inclus pour une maladie infectieuse rare
- Modalités d’administration de la dexaméthasone détaillées, avec inclusion exclusivement des patients traités selon un protocole bien conduit (administration précoce et prolongée de dexaméthasone)
- Inclusion des malades décédés au cours des 4 premiers jours (moins de 4 jours de traitement) ayant reçu de la dexaméthasone selon le protocole dans le groupe « dexaméthasone selon le protocole » afin de s’affranchir du biais de temps d’immortalité
Points faibles
- Pronostic fonctionnel évalué à court terme, à la sortie de l’hôpital
- Étude observationnelle ne permettant pas de faire un lien de causalité
- Proportion importante de patients ne recevant pas un traitement empirique couvrant Listeria monocytogenes
- Effets indésirables éventuels de la dexaméthasone non rapportés
Implications et conclusions
Cette étude observationnelle d’une qualité méthodologique comparable voire supérieure (focalisation sur une administration précoce et prolongée de dexaméthasone, davantage de patients traités par dexaméthasone) à l’étude française MONALISA suggère que, lorsque bien administrée (délai et durée), la dexaméthasone est associée à un meilleur pronostic neurologique à la sortie d’hospitalisation.
Ce résultat incite à ne désormais plus arrêter la dexaméthasone en cas de neurolistériose, en accord avec l’essai randomisé initial publié en 2002 qui avait montré une amélioration du pronostic neurologique chez les patients ayant une méningite bactérienne communautaire quelle que soit la bactérie responsable. Seul un essai randomisé comparant la dexaméthasone à un placébo chez des patients spécifiquement atteints de neurolistériose permettrait de formellement répondre à la question.
RÉFÉRENCES
1. Brouwer MC, van de Beek D (2023) Adjunctive dexamethasone treatment in adults with listeria monocytogenes meningitis: a prospective nationwide cohort study. EClinicalMedicine 58:101922. https://doi.org/10.1016/j.eclinm.2023.101922
2. de Gans J, van de Beek D, European Dexamethasone in Adulthood Bacterial Meningitis Study Investigators (2002) Dexamethasone in adults with bacterial meningitis. N Engl J Med 347:1549–1556. https://doi.org/10.1056/NEJMoa021334
3. Charlier C, Perrodeau É, Leclercq A, et al (2017) Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study. Lancet Infect Dis 17:510–519. https://doi.org/10.1016/S1473-3099(16)30521-7
4. Hoen B, Varon E, de Debroucker T, et al (2019) Management of acute community-acquired bacterial meningitis (excluding newborns). Long version with arguments. Médecine et Maladies Infectieuses 49:405–441. https://doi.org/10.1016/j.medmal.2019.03.009
5. Beek D van de, Cabellos C, Dzupova O, et al (2016) ESCMID guideline: diagnosis and treatment of acute bacterial meningitis. Clinical Microbiology and Infection 22:S37–S62. https://doi.org/10.1016/j.cmi.2016.01.007
6. McIntyre PB, Berkey CS, King SM, et al (1997) Dexamethasone as adjunctive therapy in bacterial meningitis. A meta-analysis of randomized clinical trials since 1988. JAMA 278:925–931. https://doi.org/10.1001/jama.278.11.925
7. McGill F, Heyderman RS, Michael BD, et al (2016) The UK joint specialist societies guideline on the diagnosis and management of acute meningitis and meningococcal sepsis in immunocompetent adults. J Infect 72:405–438. https://doi.org/10.1016/j.jinf.2016.01.007
CONFLIT D'INTÉRÊTS
Article commenté par Damien Contou, Réanimation polyvalente, Centre Hospitalier Victor Dupouy, Argenteuil, France.
L'auteur ne déclare pas de conflit d'intérêt en lien avec cet article.
Le contenu des fiches REACTU traduit la position de l'auteur, mais n’engage ni la CERC ni la SRLF.
Envoyez vos commentaires/réactions à l'auteur (damien.contou@ch-argenteuil.fr) et à la CERC.
CERC
G. LABRO (Secrétaire)
S. BOURCIER
A. BRUYNEEL
C. DUPUIS
S. GENDREAU
S. GOURSAUD
G. FOSSAT
N. HIMER
T. KAMEL
O. LESIEUR
A. ROUZÉ
V. ZINZONI