
Circuits between infected macrophages and T cells in SARS-CoV-2 pneumonia.
Grant RA, Morales-Nebreda L, Markov NS, Swaminathan S, Querrey M, Guzman ER, et al.
Nature. 2021 Feb 1;590(7847):635–41.
Question évaluée
Ce travail explore l’immunopathologie du développement du SDRA au cours de l’infection par SARS-CoV-2. L’approche était, sans hypothèse mécanistique préconçue, mais partait de l’idée simple que les cellules en première ligne de l’infection, en particulier les macrophages alvéolaires et les cellules épithéliales, devaient jouer un rôle clé dans l’amplification de la réponse immunitaire pulmonaire.
Type d’étude
Il s’agit d’une étude translationnelle se basant sur les données cliniques et les échantillons biologiques obtenus dans le cadre d’une cohorte prospective incluant des patients atteints de pneumonie sévère (cohorte monocentrique du Northwestern Memorial Hospital à Chicago).
Population étudiée
Cohorte prospective de patients admis en réanimation pour pneumonie et nécessitant le recours à la ventilation mécanique. L’étude prévoyait également l’inclusion de patients contrôles, admis en réanimation pour d’autres motifs qu’une pneumonie. L’étude ayant débuté en 2018, une partie de la cohorte comprend aussi des pneumonies bactériennes, fongique et virales non-SARS-CoV-2. Au final, l’étude a porté sur 88 patients atteints de pneumonie à SARS-CoV-2, 211 patients atteints de pneumonies d’autres origines, et 42 patients de réanimation « contrôles ».
Méthode
Outre le recueil des données cliniques, des lavages broncho-alvéolaires (LBA) ont systématiquement été réalisés dans les 48h après l’intubation.
Sur le liquide de LBA, plusieurs techniques d’analyses cellulaires et moléculaires ont été employées pour une analyse extensive de la réponse immunitaire :
- Cytométrie en flux : permet l’identification -et la quantification- des populations cellulaires par des marquages spécifiques ;
- Cytométrie en flux avec tri cellulaire : associe à cette technique d’identification un tri physique des cellules une à une, afin de permettre leur analyse ultérieure sur d’autres paramètres, en utilisant d’autres techniques sur ces populations cellulaires triées, comme les techniques de transcriptomique (cf. ci-dessous).
- Techniques d’analyse transcriptomique : ces techniques permettent d’analyser une très grande quantité de gènes transcrits (et l’intensité de la transcription) en séquençant et quantifiant les ARN messagers (ARNm), soit à l’échelle d’une population de cellules (« Bulk », par exemple, la population de macrophage alvéolaire dans son ensemble), soit à l’échelle individuelle cellulaire (« Single Cell », où les transcrits de chaque cellule triée sont analysés individuellement). Les données obtenues sont quantitativement lourdes à traiter et nécessitent donc des techniques d’analyses statistiques spécifiques (clustering etc.).
Résultats essentiels
- La composition cellulaire des LBA des COVID-19 graves révèle la présence accrue de monocytes et de lymphocytes T CD4 et CD8, comparativement aux pneumonies d’autres origines.
Ces résultats ont été obtenus par l’analyse en cytométrie en flux des LBA. De façon intéressante, l’analyse des LBA réalisés plus tardivement (après 48h de ventilation mécanique, sans plus de précision) retrouvait le même enrichissement en CD4 et CD8. La proportion de neutrophile n’était pas majoritaire initialement –contrairement aux autres pneumonies-, mais elle augmentait dans les LBA tardifs.
- La réponse des macrophages alvéolaires lors de l’infection par le SARS-CoV-2 possède des caractéristiques propres et se distingue de celle retrouvée dans des pneumonies d’autres causes.
Pour parvenir à cette conclusion, les auteurs ont analysé la signature transcriptomique des macrophages alvéolaires triés à partir des LBA. Sur la base de l’analyse qualitative et quantitative des ARNm de 1194 gènes des macrophages alvéolaires, les patients ayant une signature transcriptomique proche ont été groupés en différents « clusters ». Il s’avère que les patients COVID-19 se regroupaient majoritairement dans un cluster qui se caractérisait par une transcription accrue de gènes liés à la réponse interféron (qui sont des molécules majeures de la réponse immunitaire) et de gènes impliqués dans le recrutement des monocytes et lymphocytes T. De façon intéressante, les auteurs ont également mis en évidence la présence du génome de SARS-CoV-2 dans les macrophages alvéolaires dans 67% des échantillons, témoignant de l’infection de ces cellules par le SARS-CoV-2.
- L’activation des macrophages alvéolaires infectés induit le recrutement des LT CD4 et CD8
La poursuite de l’analyse s’est faite avec un niveau de finesse supplémentaire par l’étude cellule-à-cellule (« single-cell ») de la signature transcriptomique. En effet, l’étude globale d’une population -en l’occurrence, ici, les macrophages alvéolaires triés- ne permet pas de mettre en évidence d’éventuelles sous-populations qui pourraient avoir des fonctions totalement différentes. Les auteurs ont ainsi procédé à l’analyse « single-cell » des LBA de 10 patients COVID-19 et 2 contrôles. Cette analyse a effectivement révélé des populations hétérogènes de macrophages alvéolaires chez les patients COVID-19, avec notamment des macrophages dérivant de monocytes sanguins, et des macrophages résidents du tissu pulmonaire. De façon intéressante, certains macrophages alvéolaires étaient infectés par le SARS-CoV-2, et ce sont les macrophages alvéolaires résidents et infectés qui présentaient une transcription accrue des gènes impliqués dans le recrutement de monocytes et de lymphocytes et des gènes impliqués dans la réponse aux interférons. Enfin, cette analyse a également révélé que les lymphocytes T présents étaient la seule population cellulaire activant les gènes codant pour l’interféron γ. Les auteurs font ainsi logiquement l’hypothèse que les macrophages alvéolaires infectés pourraient être ciblés par la stimulation interféron des lymphocytes recrutés.
- L’infection et la réponse inflammatoire sont spatialement restreintes au sein du parenchyme pulmonaire
Sur des segments de tissus pulmonaires obtenus chez un patient décédé participant à l’étude, les auteurs ont utilisé des marquages fluorescents pour mettre en évidence le génome du SARS-CoV-2 et les macrophages alvéolaires. De façon intéressante, ils ont pu identifier la présence d’alvéoles infectées (cellules épithéliales et macrophages alvéolaires infectés), adjacentes à des alvéoles saines, témoignant de la restriction de l’atteinte.
Commentaires
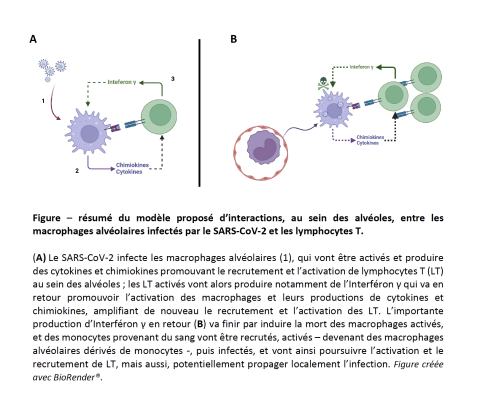
Cette étude permet de formuler une hypothèse physiopathologique de progression de la réponse inflammatoire pulmonaire au cours du COVID-19 grave, avec comme rôles clés les macrophages alvéolaires et les lymphocytes T. En effet, les macrophages infectés activent des programmes de transcription permettant de recruter les lymphocytes T, tout en augmentant leur propre programme de réponse à l’interféron. Or, les lymphocytes T recrutés dans les alvéoles, induisent fortement la transcription du gène de l’interféron-γ. L’interféron-γ produit localement va donc en retour activer les macrophages alvéolaires infectés. Cette activation des macrophages alvéolaires va stimuler le recrutement de monocytes sanguins, et aussi induire la mort des macrophages. Les monocytes nouvellement recrutés vont alors se différencier en macrophages alvéolaires (ce sont des données connues). Ces macrophages alvéolaires nouvellement différentiés vont alors eux même pouvoir être infectés par le SARS-CoV-2 et induire le recrutement des lymphocytes T et de monocytes sanguins, alimentant ainsi la boucle de réponse inflammatoire. Par ailleurs, les macrophages sont des cellules capables de se déplacer localement, et donc potentiellement de répandre le virus si elles sont infectées. Ceci pourrait expliquer la progression lente de la pneumonie avec des zones saines et des zones pathologiques, les macrophages infectés agissant comme un « cheval de Troie » en faisant progresser l’infection de proche en proche.
Points forts
Cette étude est une excellente illustration de sciences translationnelles de haut niveau : la cohorte clinique est parfaitement caractérisée et documentée, la question est certes scientifique, mais la finalité est clinique : mieux comprendre la progression du SDRA COVID-19.
Bien qu’utilisant des approches non biaisées générant des données importantes, les auteurs construisent une histoire plausible, avec une hypothèse physiopathologique. C’est la grande force de ce travail, comparativement à d’autres travaux publiés dans les mêmes grands journaux, où les données scientifiques s’accumulent de façon descriptive, mais sans apporter de connaissance avec une réelle plus-value clinique ou même physiopathologique.
Points faibles
Ce travail a cependant une limite majeure : même si les données sont convaincantes, le modèle donné reste une hypothèse basée sur les résultats. Ce travail fournit donc un modèle testable, mais il n’est pas apporté ici, de preuve mécanistique de ces interactions.
Implications et conclusion
Dans la lignée des travaux observationnels préliminaires précédents, cette étude vient appuyer l’hypothèse d’un rôle majeur des macrophages alvéolaires –infectés- et des lymphocytes T dans la physiopathologie du COVID-19 grave, en proposant l’existence d’une potentielle boucle d’amplification entre ces deux populations interagissant au sein des alvéoles.
La démonstration de la réalité de ces interactions pourrait ouvrir des pistes d’exploration de ciblage de cette boucle d’amplification dans un but thérapeutique. Sur le plan physiopathologique, cette hypothèse incite également à ré-explorer la physiopathologie des SDRA hors COVID-19 à la lumière de ces données.
CONFLIT D'INTÉRÊTS
Article commenté par Youenn Jouan, pour la Commission de la Recherche Translationnelle de la SRLF.
L'auteur déclare n'avoir aucun lien d'intérêt en lien avec ce travail.
Le contenu des fiches REACTU traduit la position de leurs auteurs, mais n’engage ni la CERC ni la SRLF.
Envoyez vos commentaires/réactions aux auteures (youenn.jouan@gmail.com) et à la CERC.
CERC
G. LABRO (Secrétaire)
S. BOURCIER
A. BRUYNEEL
C. DUPUIS
S. GENDREAU
S. GOURSAUD
G. FOSSAT
N. HIMER
T. KAMEL
O. LESIEUR
A. ROUZÉ
V. ZINZONI