
Voiriot G, Argaud L, Cohen Y, Tuffet S, Chauvelot L, Souweine B, Klouche K, Reignier J, Schwebel C, Rouzé A, Mekontso Dessap A, Bohé J, Megarbane B, Carvelli J, Navellou JC, Gibot S, Maury É, Dellamonica J, Dequin PF, Dessajan J, Armand-Lefèvre L, Vandenesch F, Verdet C, Durand Zaleski I, Bérard L, Rousseau A, Tabassome S, Fartoukh M, Timsit JF; MULTI-CAP collaborative trial group. Combined use of a multiplex PCR and serum procalcitonin to reduce antibiotic exposure in critically ill patients with community-acquired pneumonia: the MULTI-CAP randomized controlled trial. Intensive Care Med. 2025 Aug;51(8):1417-1430. doi: 10.1007/s00134-025-08014-9. Epub 2025 Jul 15. PMID: 40663137.
Question évaluée :
L’étude MULTI-CAP évaluait si une stratégie combinant panel mPCR pneumonie (BioFire Pneumonia Plus) et procalcitonine (PCT), appliquée via un algorithme standardisé de désescalade ou arrêt précoce des antibiotiques, permettait de réduire l’exposition aux antibiotiques chez les patients en réanimation pour pneumonie communautaire (CAP) sévère.
Type d’étude :
MULTI-CAP est un essai randomisé contrôlé, multicentrique, en groupes parallèles, ouvert et de supériorité, conduit dans 20 réanimations françaises.
Population étudiée :
Patients adultes, non immunodéprimés, hospitalisés en réanimation pour pneumonie communautaire grave. L’essai a inclus 406 patients dont 385 patients analysés.
Méthode :
Essai comparant :
- Stratégie interventionnelle : microbiologie conventionnelle + mPCR BioFire® Pneumonia Plus Panel + PCT sériée + algorithme de désescalade/arrêt précoce sur l’ensemble des données à J0-J1 puis guidage PCT à partir de J3
- Stratégie standard : microbiologie conventionnelle seule + guidage PCT de J3 à J7 selon recommandations internationales sur l’antibiothérapie disponibles pour le prescripteur
Avant J1 :
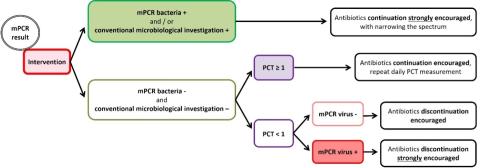
A partir de J3 :
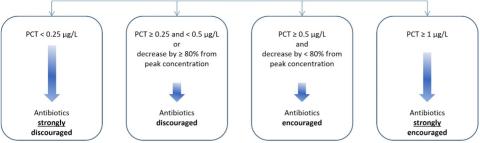
Critère de jugement principal : nombre de jours vivants sans antibiotiques entre J0 et J28.
Critères de jugement secondaires : mortalité J28/J90, exposition cumulative, surinfections, durée de séjour, coût, qualité de vie.
Résultats essentiels :
Critère de jugement principal :
- Aucun effet sur le nombre de jours vivants sans antibiotique à J28
- 19 jours (IQR 0–24) dans la stratégie interventionnelle
- 19 jours (IQR 7–22) dans le standard
Critères de jugement secondaires :
- Durée cumulative d’antibiothérapie réduite de seulement 3 jours (IC95% –5.1 à –0.9).
- Léger avantage à J7 (1 jour d’exposition antibiotique en moins), mais sans traduction à J28.
- Pas d’effet sur mortalité, surinfections, durée de séjour, exposition globale aux antibiotiques larges spectres.
Autre résultat d’intérêt :
La mPCR augmente la détection microbiologique de certains micro-organismes, notamment S. pneumoniae, S. aureus, P. aeruginosa, L. pneumophila
Commentaires :
Ce résultat n’est pas forcément surprenant : la littérature montre que les stratégies reposant sur mPCR ne réduisent que rarement l’antibiothérapie (notamment aux urgences) (1-5). Pour la PCT, les études sont contradictoires mais l’étude PRORATA, notamment, en réanimation montrait un bénéfice (6-7).
Cependant, la pratique clinique montre que mPCR et PCT sont des outils puissants mais ambivalents, notamment aux urgences ou en service conventionnel (médecine, chirurgie) :
- La mPCR détecte de nombreux micro-organismes, dont certains non cliniquement pertinents (portage, contaminations, faible inoculum).
- La PCT, mal interprétée, peut rassurer à tort ou inquiéter inutilement.
Ces deux outils, lorsqu’ils ne sont pas parfaitement intégrés dans une démarche de stewardship experte, peuvent même produire des effets antagonistes. Ce sont potentiellement des armes à double tranchant, et le résultat négatif de MULTI-CAP pourrait aller dans ce sens.
Points forts :
- Étude multicentrique de grande ampleur (20 réanimations), haute qualité méthodologique.
- Stratégie d’intervention multimodale : diagnostic (mPCR) + biomarqueur (PCT) + algorithme opérationnel pour guider la prise en charge, rare dans les essais de diagnostic stewardship.
- stratégie dans le groupe contrôle : très bien documentée, rare également.
- Intérêt pour la documentation microbiologique : la mPCR a permis d’identifier plus de pathogènes, en particulier S. pneumoniae, H. influenzae, Legionella pneumophila.
- Possibilité d’évaluer plus précisément l’implémentation, l’observance concernant l’algorithme est rapportée et c’est un point très fort (75 %).
Points faibles :
- Bras « contrôle » est en cours de modification dans les réanimations
Dans de nombreuses réanimations françaises, la mPCR est déjà disponible en routine, ce qui rend la séparation intervention/standard moins nette qu’auparavant
- Intervention multimodale peut être difficilement interprétable : l’association mPCR + PCT entraîne des interactions complexes, potentiellement opposées. Difficile de déterminer quelle composante influence réellement les décisions.
- Intérêt d’une approche encore plus multimodale (mais plus complexe à mettre en œuvre) avec par exemple un programme de formation, ou un audit-feedback en temps réel.
- Il pourrait s’y associer des indicateurs d’implémentation robustes (type Proctors’ outcomes : fidelity, reach, acceptability, adoption, etc.)
Implications et conclusions :
Cette étude souligne que l’impact des technologies diagnostiques rapides dépend étroitement de leur contexte d’implémentation.
La mPCR constitue un outil performant lorsqu’elle est interprétée par des experts et intégrée à une stratégie structurée de stewardship ; utilisée isolément et notamment en dehors de la réanimation, elle peut conduire à une documentation non pertinente, à des prolongations inutiles d’antibiothérapie ou à des explorations superflues.
A l’inverse, la documentation de germes plus difficiles en culture à mettre en évidence comme la légionelle ont pu expliquer une partie des antibiothérapies plus prolongées.
Le même constat s’applique à la procalcitonine, dont l’usage en dehors de la réanimation reste souvent hétérogène et parfois inapproprié, justifiant une évaluation critique de son applicabilité.
Dans les réanimations engagées dans MULTI-CAP, le niveau de stewardship était potentiellement déjà élevé (durées courtes, guidage PCT, microbiologie performante), laissant peu de marge d’amélioration (high hanging fruit). Les enjeux se situent potentiellement ailleurs : réduction de l’antibiothérapie dans des contextes moins « contrôlés » et/ou intégration de la mPCR au sein d’interventions encore plus
multimodales.
Références citées dans les commentaires:
- Andrews D, Chetty Y, Cooper BS, et al. Multiplex PCR point-of-care testing versus routine laboratory-based testing in the treatment of adults with respiratory tract infections: a quasi-randomised study assessing impact on length of stay and antimicrobial use. BMC Infect Dis. 2017;17:671.
- Brendish NJ, Malachira AK, Armstrong L, et al. Routine molecular point-of-care testing for respiratory viruses in adults presenting to hospital with acute respiratory illness (ResPOC): a pragmatic, open-label, randomised controlled trial. Lancet Respir Med. 2017;5:401-411.
- Echavarría M, Marcone DN, Querci M, et al. Clinical impact of rapid molecular detection of respiratory pathogens in patients with acute respiratory infection. J Clin Virol. 2018;108:90-95.
- Gelfer G, Leggett J, Myers J, et al. The clinical impact of the detection of potential etiologic pathogens of community-acquired pneumonia. Diagn Microbiol Infect Dis. 2015;83:400-406.
- Saarela E, Tapiainen T, Kauppila J, et al. Impact of multiplex respiratory virus testing on antimicrobial consumption in adults in acute care: a randomized clinical trial. Clin Microbiol Infect. 2020;26:506-511.
- Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C, et al. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet.2010;375(9713):463-74.
- Velly L, Cancella de Abreu M, Boutolleau D, Cherubini I, Houas E, Aurousseau A, et al. Point-of-care multiplex molecular diagnosis coupled with procalcitonin-guided algorithm for antibiotic stewardship in lower respiratory tract infection: a randomized controlled trial. Clin Microbiol Infect. 2023;29(11):1409-16. doi:10.101
CONFLIT D'INTÉRÊTS
Commenté par Nathan Peiffer-Smadja, Service de Maladies Infectieuses et Tropicales, Hôpital Bichat – Claude Bernard, AP-HP, Paris, France.
Le contenu des fiches REACTU traduit la position de leurs auteurs, mais n’engage ni la CERC ni la SRLF.
Voir les déclarations de conflits d'intérêt (titre cliquable): Nathan Peiffer-Smadja
Envoyez vos commentaires/réactions à Nathan.peiffer-smadja@aphp.fr et à la CERC.
CERC
G. LABRO (Secrétaire)
S. BOURCIER
A. BRUYNEEL
A.CAILLET
C. DUPUIS
N. FAGE
JP. FRAT
G. FOSSAT
A. GAILLET
S. GENDREAU
S. GOURSAUD
N. HIMER
O. LESIEUR
A. ROUZÉ
M. THY