
Hernandez G, Ospina-Tascón GA, Kattan E, Ibarra-Estrada M, Ramasco F, Orozco N, Ramos K, Aldana JL, Ferri G, Hamzaoui O, De Backer D, Teboul JL, Vieillard-Baron A, Petri Damiani L, García-Gallardo GA, Morales S, Carmona Garcia P, Mendez R, Hernandez-Gilsoul T, Pérez-Nieto OR, Olea Vielba C, Ramos S, Dominguez D, Bruna M, David S, Wendel-Garcia PD, Galiana-Ivars M, Myatra SN, Messina A, Cecconi M, Pozo M, Amthauer M, Higuera E, Al Duhalib Z, Rico-Feijoo J, Ferrer-Gómez C, Pérez-Carbonell A, Martinez-Castro S, Redondo Calvo FJ, Vives M, Sanchez HF, Bilbao I, Fernandez P, Al-Fares A, Benitez-Cano A, Gonzalez C, Reyes LF, Rodriguez-Guillen JH, Cristino AV, Pendino JC, Ortiz G, Alonso-Gonzalez MC, Murias G, Aguirre-Ávalos G, Hernández L, Calderón Barajas ZA, Zarragoikoetxea I, Monnet X, Goury A, Mendonça Dos Santos T, Vallecilla L, Martins de Lima L, Sady E, Alegria L, Ostermann M, Bakker J, Biasi Cavalcanti A. Personalized Hemodynamic Resuscitation Targeting Capillary Refill Time in Early Septic Shock: The ANDROMEDA-SHOCK-2 Randomized Clinical Trial. JAMA. 2025 Dec 9;334(22):1988-1999. doi: 10.1001/jama.2025.20402. PMID: 41159835; PMCID: PMC12573117.
Question évaluée :
Quel est l’impact d’un protocole de gestion hémodynamique multimodal et personnalisé, ayant comme objectif principal la normalisation du temps de recoloration cutanée (TRC), lors de la phase initiale du choc septique ?
Type d’étude :
Essai prospectif, multicentrique, international, randomisé, stratifié par centre, conduit en ouvert.
Population étudiée :
Patients adultes (≥ 18 ans) présentant un choc septique évoluant depuis moins de 4 heures, défini par une infection suspectée ou confirmée, avec :
une lactatémie artérielle ≥ 2 mmol/L après au moins 1000 mL de remplissage vasculaire,
et la nécessité d’une perfusion de noradrénaline pour maintenir une pression artérielle moyenne (PAM) ≥ 65 mmHg.
Méthode :
Les patients étaient randomisés en 2 groupes :
Un groupe recevant une prise en charge habituelle, reposant sur les recommandations internationales (1) .
Un groupe interventionnel faisant l’objet d’une prise en charge reposant sur un algorithme séquentiel personnalisé mis en place durant les six premières heures, visant la normalisation du TRC. Le reste de la prise en charge était laissé à la discrétion des cliniciens.
Le TRC était évalué de façon standardisée et uniformisée dans tous les centres en appliquant une pression sur la face ventrale de la phalange distale de l’index, en utilisant une lame de microscope en verre, jusqu'à ce que la peau devienne blanche, maintenue pendant 10 secondes, puis relâchée. Le temps nécessaire pour que la peau retrouve sa couleur normale a été mesuré à l'aide d'un chronomètre et un temps de recoloration supérieur à 3 secondes a été défini comme anormal.
Ci-joint un schéma de l’algorithme de prise en charge :
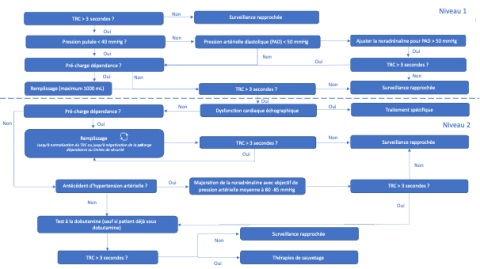
L’algorithme repose sur une approche multimodale et progressive intégrant successivement l’analyse de la pression pulsée, de la pression artérielle diastolique, l’évaluation de la précharge-dépendance et l’échocardiographie ciblée, afin d’orienter de façon raisonnée l’administration de fluides, de vasopresseurs ou d’inotropes. Toute administration de remplissage était précédée d’une évaluation systématique de la réponse à la volémie, conformément aux principes actuels de la réanimation hémodynamique (2).
Avant le début des inclusions, tous les cliniciens participants ont suivi une formation obligatoire sur les procédures et le protocole de l’étude, incluant supports pédagogiques, cas cliniques fictifs et sessions virtuelles avec le centre coordinateur. L’adhésion au protocole a été auditée par une équipe dédiée du service par une analyse hebdomadaire cas par cas des patients du groupe CRT-PHR, avec identification des écarts au protocole et retour précoce aux centres participants.
Le critère de jugement principal était un critère composite hiérarchisé, évalué à J28, comprenant :
La mortalité toute cause
La durée de support d’organes (vasopresseurs, ventilation mécanique, épuration extra-rénale)
La durée d’hospitalisation
L’analyse reposait sur la méthode du win ratio, stratifié sur le score APACHE II, qui consiste à comparer les patients deux à deux, avec une hiérarchie pré-établie dans les critères, en mesurant à quelle fréquence le groupe interventionnel “gagne” face au groupe contrôle. Ainsi en cas « d’égalité » sur la mortalité, les patients sont comparés sur la durée globale de support d’organes et enfin sur la durée d’hospitalisation.
La mortalité estimée à 28 jours dans le groupe prise en charge habituelle était de 39%, avec une moyenne de jours sous support d’organe chez les patients vivants de 5.6 jours et une durée d’hospitalisation de 15.6 jours. Dans le groupe intervention, la mortalité attendue était de 33%, avec une moyenne de jours sous support d’organe de 3,4 jours et une durée d’hospitalisation de 14 jours.
Les critères de jugement secondaires testés séquentiellement étaient :
La mortalité toute cause
La durée sans support d’organe durant les 28 jours après inclusion
Durée d’hospitalisation durant les 28 jours après inclusion.
Résultats essentiels :
Au total, 1501 patients ont été randomisés, dont 744 dans le bras intervention et 757 dans le bras standard.
Les caractéristiques initiales étaient comparables entre les groupes, avec un âge moyen d’environ 65 ans, un score SOFA médian de 8, avec des sepsis majoritairement d’origine digestive (50% des patients), respiratoire et urinaire (environ 20%).
À l’inclusion (en moyenne dans les 2 heures après le diagnostic de choc septique), environ 60 % présentaient un TRC > 3 secondes, près de la moitié des patients étaient ventilés, ils avaient reçu en moyenne un peu plus de 20 mL/kg de remplissage et était sous 0.2 µg/kg/min de noradrénaline.
La normalisation du TRC était significativement plus fréquente dans le groupe interventionnel que dans le groupe contrôle à 6h (85,9 % vs 61,7 %, respectivement 94% et 92% des patients survivants à ce temps d’évaluation), avec 65% de normalisation du TRC dans le groupe CRT-PHR au décours du premier niveau de prise en charge (cf algorithme). Les patients du groupe interventionnel ont reçu significativement moins de remplissage vasculaire (595 vs 847 mL), davantage de dobutamine (12,3 % vs 5,3 %) et présentaient une lactatémie plus basse à 6 heures (3,2 vs 3,5 mmol/L). Dans le groupe interventionnel, peu de violation (5%) et de déviation (15%) de protocole ont été relevées.
Concernant le critère principal, le groupe interventionnel présentait davantage de victoires que le groupe contrôle, avec un win ratio de 1,16 [IC 95 % 1,02–1,33] ; p = 0,04. Cet effet était principalement porté par la réduction de la durée de support d’organes (16.5 vs 15.4 jours sans support d’organe à j28, proportionnal OR 1.28 [1.06 ; 1.54]) tandis que la durée d’hospitalisation (15.3 vs 16.2 jours) et la mortalité toutes causes à J28 (26.5% vs 26.6%) n’étaient pas significativement différentes.
L’étude était stratifiée selon le score APACHE II (supérieur ou inférieur à 19), mettant en évidence un bénéfice de l’intervention plutôt chez les patients les plus grave (win ratio respectivement de 1.12 [IC 95 % 0.95–1,34] et 1.22 [IC 95 % 1,01–1,46] pour les scores APACHE II bas et haut).
Commentaires :
Depuis l’essai de Rivers et al. publié en 2001 dans le New England la réanimation hémodynamique précoce guidée par des objectifs a structuré la prise en charge du choc septique (3).
Toutefois, les cibles optimales de cette réanimation demeurent débattues. ANDROMEDA-SHOCK-2 s’inscrit dans une recherche plus récente visant à personnaliser la prise en charge et identifier un marqueur simple, reproductible et cliniquement pertinent de la perfusion tissulaire (4).
Cet essai prolonge les résultats d’ANDROMEDA-SHOCK, qui avait déjà montré une récupération plus rapide des défaillances d’organes et un signal en faveur d’une amélioration du pronostic avec une stratégie guidée par le TRC comparée à une stratégie guidée par la lactatémie (5).
La persistance d’un TRC anormal malgré une correction apparente des paramètres hémodynamiques peut refléter une dissociation entre la macro et la microcirculation, phénomène bien décrit au cours du choc septique (6). En ce sens, l’évaluation répétée de la perfusion périphérique permettrait d’éviter un remplissage excessif et potentiellement délétère (7).
L’étude montre une supériorité de la stratégie fondée sur le TRC sur un critère de jugement composite hiérarchisé comprenant la mortalité, la durée de support d’organes et la durée d’hospitalisation au 28e jour.
Points forts :
- Essai multicentrique international de grande ampleur, conférant une haute validité externe avec des pays avec conditions de ressources et d’accès aux soins variables
- Intervention précoce, standardisée avec un rationnel physiopathologique.
- Critère de jugement composite hiérarchisé objectif, non-sujet à un biais de classement et par conséquent permettant une conception en ouvert, nécessaire pour l’étude.
Points faibles :
- Faisabilité décrite comme facile par les auteurs, qui semble néanmoins nécessiter un temps médical et paramédical conséquent.
- Algorithme de prise en charge laissée à l’appréciation du clinicien avec notamment absence de protocole de sevrage des assistances d’organe
- Pas d’impact sur la mortalité.
Implications et conclusions :
Chez les patients en choc septique précoce, une réanimation hémodynamique personnalisée intégrant le temps de recoloration cutanée (TRC) comme cible apparaît supérieure à la prise en charge habituelle pour réduire la durée de support d’organes. Le TRC constitue un outil simple, peu coûteux et largement généralisable pour le monitorage de la perfusion périphérique au lit du patient.
Une stratégie pilotée par le TRC permet de corriger, dès les six premières heures de prise en charge, une anomalie de perfusion tissulaire dans environ 65 % des cas, au moyen d’interventions classiques de réanimation (expansion volémique raisonnée, maintien d’une pression artérielle diastolique > 50 mmHg, ou recours à la dobutamine en cas de dysfonction cardiaque).
Néanmoins, près de 15 % des patients ne normalisent pas leurs anomalies de perfusion tissulaire à J3. Le phénotypage précoce et précis de cette population apparaît dès lors comme une piste de recherche pertinente afin d’identifier d’éventuelles stratégies thérapeutiques spécifiques.
La mortalité observée dans le groupe prise en charge habituelle étant nettement inférieure à celle anticipée par les auteurs, ceci pourrait en partie expliquer l’absence d’effet de la stratégie guidée par le TRC sur la survie.
Le message principal de l’étude est ainsi de recentrer le clinicien au lit du patient, en intégrant de manière systématique, répétée et standardisée la surveillance de la perfusion tissulaire dans la prise en charge du choc septique. Le TRC s’inscrit comme un outil fiable, en complément de l’évaluation clinique (score de marbrures, diurèse), des paramètres macrocirculatoires et de l’échocardiographie.
Références cités dans les commentaires :
Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. nov 2021;47(11):1181‑247.
Monnet X, Shi R, Teboul JL. Prediction of fluid responsiveness. What’s new? Ann Intensive Care. déc 2022;12(1):46.
Rivers E, Nguyen B, Havstad S, Ressler J, Muzzin A, Knoblich B, et al. Early Goal-Directed Therapy in the Treatment of Severe Sepsis and Septic Shock. N Engl J Med. 8 nov 2001;345(19):1368‑77.
Machado FR, Semler MW. Capillary Refill Time in Sepsis—Searching for the Holy Grail. JAMA. 9 déc 2025;334(22):1983.
Hernández G, Ospina-Tascón G, Damiani L, Estenssoro E, Dubin A, Hurtado J, et al. Effect of a Resuscitation Strategy Targeting Peripheral Perfusion Status vs Serum Lactate Levels on 28-Day Mortality Among Patients With Septic Shock: The ANDROMEDA-SHOCK Randomized Clinical Trial. JAMA. 2019;321:654.
De Backer D, Donadello K, Sakr Y, Ospina-Tascon G, Salgado D, Scolletta S, et al. Microcirculatory Alterations in Patients With Severe Sepsis: Impact of Time of Assessment and Relationship With Outcome*. Critical Care Medicine. mars 2013;41(3):791‑9.
Mekontso Dessap A, AlShamsi F, Belletti A, De Backer D, Delaney A, Møller MH, et al. European Society of Intensive Care Medicine (ESICM) 2025 clinical practice guideline on fluid therapy in adult critically ill patients: part 2—the volume of resuscitation fluids. Intensive Care Med. mars 2025;51(3):461‑77.
CONFLIT D'INTÉRÊTS
Commenté par Valentin de Villiers de la Noue et Jean-Rémi Lavillegrand, Médecine Intensive Réanimation, Hôpital Européen Georges Pompidou, France.
Le contenu des fiches REACTU traduit la position de leurs auteurs, mais n’engage ni la CERC ni la SRLF.
Voir les déclarations de conflits d'intérêt (titre cliquable): Jean-Rémi Lavillegrand
Envoyez vos commentaires/réactions à Jean-remi.lavillegrand@aphp.fr et à la CERC.
CERC
G. LABRO (Secrétaire)
S. BOURCIER
A. BRUYNEEL
A.CAILLET
C. DUPUIS
N. FAGE
JP. FRAT
G. FOSSAT
A. GAILLET
S. GENDREAU
S. GOURSAUD
N. HIMER
O. LESIEUR
A. ROUZÉ
M. THY